Het idee dat alle stoffen in de wereld uit atomen bestaan, ontstond in de 5e eeuw voor Christus, toen de oude Griekse denker Democritus suggereerde dat alles wat bestaat bestaat uit de kleinste bewegende deeltjes. Je zou alleen kunnen aannemen dat het hoogstwaarschijnlijk niet zonder betekenis is. Vele eeuwen na Democritus werden atomen periodiek teruggeroepen, maar deze hypothese was in die verre tijden niet populair. In de 19e eeuw verscheen de atoomhypothese opnieuw aan de wetenschappelijke horizon.
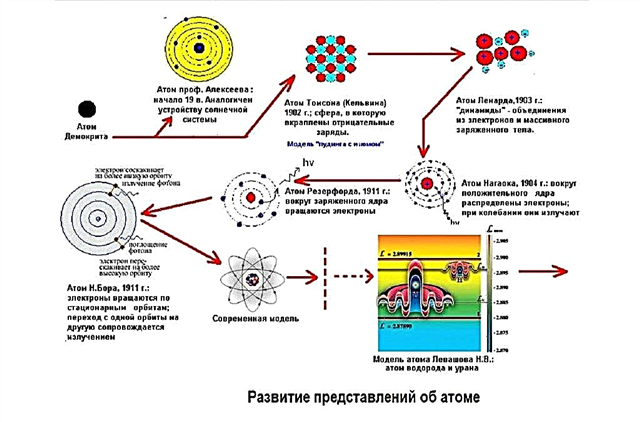
Atom structuurmodellen

Wetenschappers waren op zoek naar een model dat het beeld van de echte wereld op bevredigende wijze kon beschrijven. Het atoom bleek een zeer geschikt model. Hoewel atomen niet te zien zijn, maar door ze te laten bestaan, konden wetenschappers uitleggen wat ze in hun experimenten en in de natuur waarnamen.
Wetenschappers waren al lang voordat ze het konden bewijzen overtuigd van het bestaan van atomen. Het model werkte, hoewel niemand de waarheid kon bewijzen. Zo ontdekte de Engelse wetenschapper John Dalton in het begin van de 19e eeuw, die de wetten van chemische reacties bestudeerde, dat twee stoffen altijd chemisch reageren in dezelfde constante verhouding. Zo levert de combinatie van één deel zuurstof en twee delen waterstof water op.
Dit suggereerde dat de atomen van één substantie, qua massa gelijk aan elkaar, verbonden waren met atomen van een andere substantie (dat wil zeggen met atomen met een andere massa). Bij watervorming combineert één zuurstofatoom met twee waterstofatomen.Het atoommodel hielp te begrijpen wat Dalton precies waarnam in zijn experimenten. Er is verder eenvoudig bewijs voor het bestaan van atomen.
Als je naar een microscoop kijkt naar pollendeeltjes die in water zweven, zie je dat ze chaotische bewegingen maken. Waarom? Wetenschappers hebben gesuggereerd dat dit te wijten kan zijn aan het feit dat stuifmeeldeeltjes in botsing komen met talloze atomen of groepen atomen die wetenschappers moleculen hebben genoemd (bijvoorbeeld deeltjes in water botsen met watermoleculen).
Waaruit bestaat een atoom?
Wetenschappers die het eens waren met de atoomtheorie, geloofden dat een atoom bestaat uit kleine elektrisch geladen deeltjes - positief en negatief, die, wanneer ze in een atoom worden gecombineerd, zoals in een bal, elkaar neutraliseren en het atoom als geheel elektrisch neutraal maken. Maar in 1907 bewees de Engelse natuurkundige Ernest Rutherford met zijn experimenten dat dit niet helemaal waar is.
Rutherford Experience
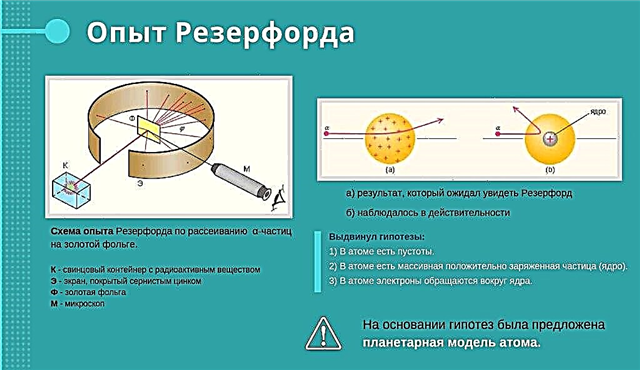
Rutherford beschoot een goudfolie met een hogesnelheidsstraal van positief geladen deeltjes. Hij geloofde dat deeltjes door de folie zouden gaan. Sommige positief geladen deeltjes vlogen wel door de folie. En sommigen konden dit niet. Bovendien ketsten ze af in de experimentator, alsof een of andere kracht die in de folie verborgen zat, hen wegduwde. Rutherford was verrast. Hij zei dat het hetzelfde was als het beginnen met het verbranden van de pot op vezelig papier en plotseling zien hoe de pot van het voorhoofd van de pottenbakker vliegt.
Planetair atoommodel - Atoomkern
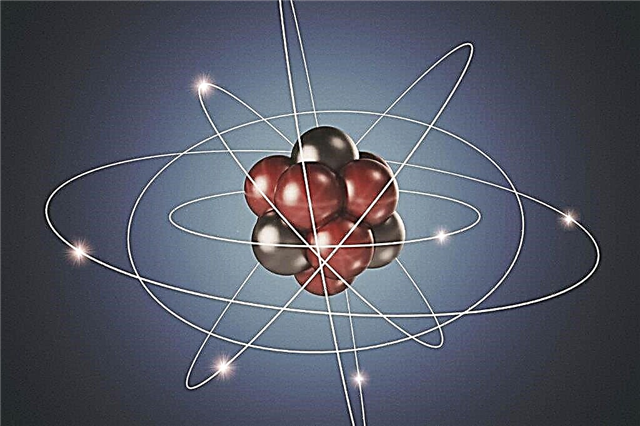
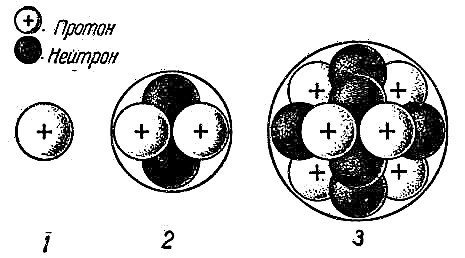
De experimenten van Rutherford hielpen de atoomhypothese te bevestigen en te begrijpen hoe het atoom werkt. Het werd duidelijk dat de positieve en negatieve deeltjes niet gelijkmatig verdeeld zijn in het atoom. Als dat zo was, zouden positief geladen deeltjes in het Rutherford-experiment niet met zo'n kracht worden afgestoten. Daarom is de kern van een atoom niet neutraal. In het midden van het atoom bevindt zich een dichte bal van deeltjes, dat wil zeggen in het midden, die de kern van het atoom wordt genoemd, positief geladen protonen en neutrale neutronen.
Op een aanzienlijke afstand van de kern draaien negatief geladen deeltjes - elektronen - rond de banen eromheen. Omdat een positieve lading in waarde gelijk is aan een negatieve lading, is het atoom als geheel elektrisch neutraal. Er zijn geen kosten aan verbonden.
Maar de kern zelf is de concentratie van een positieve lading. Veel van de positieve deeltjes in het experiment van Rutherford vlogen te dicht bij de positief geladen kern van een goudatoom. Omdat positieve ladingen elkaar wederzijds afstoten, vlogen deze deeltjes terug naar de experimentator. Dit bracht hem op het idee hoe atomen eigenlijk zijn gerangschikt.
Quarks
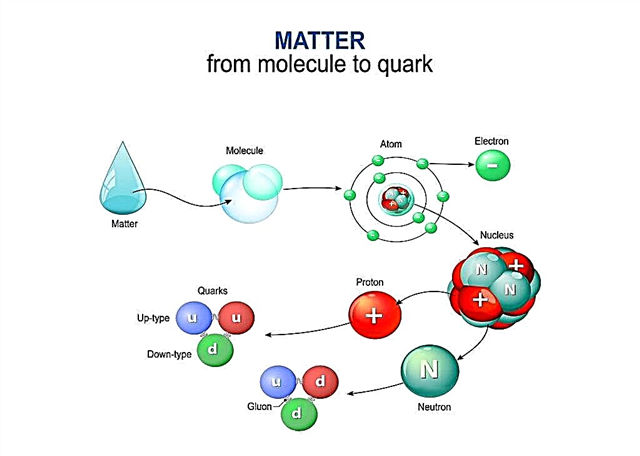
Protonen en neutronen zijn deeltjes die, hoewel ze zelf klein zijn, bestaan uit nog kleinere deeltjes die quarks worden genoemd. Tegenwoordig geloven wetenschappers dat protonen en neutronen bestaan uit nog kleinere deeltjes die quarks worden genoemd.
Quarks zijn een nieuw model dat het gedrag van atomen in de echte wereld beter verklaart. En net zoals wetenschappers eerder experimenteel bewijs hadden gezocht voor het bestaan van atomen, zoeken ze nu naar echte bevestiging van het bestaan van quarks.